Los biofilms se definen como comunidades de microorganismos que crecen embebidos en una matriz de exopolisacáridos y adheridos a una superficie inerte o un tejido vivo. El crecimiento en biofilms representa la forma habitual de crecimiento de los microorganismos en la naturaleza. El ejemplo típico de biofilm lo constituye la placa dental, día a día nos esforzamos por combatir la película de bacterias que recubre la superficie de los dientes para evitar un desarrollo excesivo de microorganismos que puede provocar un deterioro del esmalte dental. La capacidad de formación de biofilm no parece estar restringida a ningún grupo específico de microorganismos y hoy se considera que bajo condiciones ambientales adecuadas todos, o la gran mayoría de los microorganismos son capaces de formar biofilm.
Diagrama de la formación de la biopelícula en el conducto radicular. a) Conducto vacío, b) Invasión de los microorganismos al interior del conducto radicular, c) Vehículo fluido en el SCR proveniente de la región apical, d) Formación de biopelículas en las paredes del conducto principal y en zonas alejadas del mismo
Lesión (mancha blanca) y carie cavitada
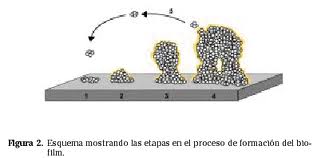
Etapas en el proceso de la formación de biofilm. La etapa inicial del proceso de formación del biofilm es la adherencia a la superficie. En bacterias Gram negativas (como Pseudomonas aeruginosa, Vibrio cholerae, Escherichia coli, Salmonella enterica) se ha visto que los flagelos y fimbria son importantes para la etapa de adherencia primaria. La motilidad parece ser que ayuda a la bacteria a alcanzar la superficie y contrarrestar las repulsiones hidrofóbicas. Sin embargo, aunque la motilidad ayuda al proceso no parece ser un requisito esencial, muchas bacterias Gram positivas inmóviles como estafilococos, estreptococos y micobacterias son capaces de formar biofilm. En el caso de las bacterias Gram positivas se ha descrito la participación de algunas proteínas de superficie en esta primera etapa de adherencia primaria. Una vez que la bacteria se ha adherido a la superficie, comienza a dividirse y las células hijas se extienden alrededor del sitio de unión, formando una microcolonia similar a como ocurre durante el proceso de formación de colonias en placas de agar. En una etapa posterior el microorganismo comienza a secretar un exopolisacárido que constituye la matriz del biofilm y forma unas estructuras similares a setas (mushrooms) entre las cuales se observa la presencia de canales. La composición del exopolisacárido es diferente en cada bacteria y varía desde alginato en P. aeruginosa, celulosa en S. typhimurium, un exopolisacárido rico en glucosa y galactosa en V. cholerae, poly-N-acetilglucosamina en S. aureus, etc. Además, estudios recientes han puesto de manifiesto que incluso una misma bacteria, dependiendo de las condiciones ambientales en las que se encuentre, puede producir distintos exopolisacáridos como componentes de la matriz del biofilm. Así, algunas cepas de P. aeruginosa son capaces de producir además de alginato un polisacárido rico en glucosa que forma una película en la interface medio aire al que se ha denominado Pellican.
Biofilm e infección
Aunque normalmente se asocian los biofilms bacterianos con procesos infecciosos, es necesario señalar que algunos biofilms tienen un papel protector. Así, los biofilms de lactobacilos presentes en la vagina fermentan el glucógeno producido por las células epiteliales al ser inducidas por los estrógenos, produciendo ácidos que disminuyen el pH vaginal y previenen de esa manera la colonización por microorganismos patógenos. La desaparición de este biofilm con la consiguiente neutralización del pH suele venir acompañada del desarrollo de microorganismos patógenos como Gardnerella vaginalis y otros microorganismos anaerobios. Otro ejemplo de biofilms beneficiosos lo constituyen los biofilms formados sobre la superficie de los dientes, que protegen frente a la colonización por otros patógenos exógenos. Este biofilm suele estar compuesto en una persona por 20-30 especies bacterianas distintas, entre las que invariablemente destacan en número los estreptococos y Actinomyces sp. Las bacterias de la placa dental viven en equilibrio mientras las condiciones externas se mantengan constantes. Una persona que consuma muchos alimentos o bebidas ricas en azúcares, favorecerá el desarrollo de especies bacterianas que fermentan los azúcares, desequilibrando la población bacteriana y favoreciendo el desarrollo de especies como Streptococcus mutans y Lactobacillus sp., que producen ácidos que disuelven el esmalte protector de los dientes. La consecuencia final es el desarrollo de las dos infecciones más prevalentes en el hombre, la caries y la periodontitis. Junto al papel beneficioso de los biofilms bacterianos, existen numerosas evidencias epidemiológicas que relacionan los biofilms con distintos procesos infecciosos. La infección asociada a tejido dañado-cuerpo-extraño-biomaterial incluye una serie de características comunes: 1. Colonización de sustratos por bacterias adhesivas formadoras de biofilm. 2. Presencia de un biomaterial, tejido dañado, o sustrato de tejido relativamente acelular. 3. Iniciación de infección por pequeños inóculos bacterianos. 4. Resistencia mediada por el biofilm bacteriano a los mecanismos de defensa del huésped y a la terapia antibiótica. 5. Infecciones causadas con mucha frecuencia por Staphylococcus aureus, Staphylococcus epidermidis y Pseudomonas aeruginosa. 6. Infecciones persistentes por resistencia al tratamiento antimicrobiano. 7. Presencia de inflamación, tejido celular dañado, y necrosis en la interface tejido-implante generado por partículas del biomaterial. 8. Alteración de la respuesta mediada por células y posiblemente humoral del huésped por la presencia del biomaterial y bacterias27 Algunos ejemplos de infecciones relacionadas con biofilm bacteriano son: Endocarditis de válvulas nativas Resulta de la interacción de bacterias u hongos con las válvulas mitral, aorta, tricúspide o pulmonar. Los organismos responsables, principalmente estreptococos y estafilococos que alcanzan el torrente sanguíneo desde la orofaringe, el tracto gastrointestinal o el tracto genitourinario. Estas bacterias normalmente no se adhieren sobre las válvulas intactas, pero si se produce alguna lesión sobre las mismas, las células endoteliales secretan fibronectina, que es utilizada como receptor por adhesinas específicas de la superficie de las bacterias. Las bacterias se multiplican en la lesión y forman el biofilm, lo cual acentúa el daño y puede provocar embolias sépticas. Una vez que el biofilm se ha establecido, los tratamientos antibióticos resultan poco efectivos Otitis media Es una infección que afecta al oído medio, muy frecuente en niños, que puede cursar de forma aguda o crónica y que es causada por un grupo variable de microorganismos, incluyendo, Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus y Pseudomonas aeruginosa. Una forma de aliviar la presión sobre la membrana timpánica y aumentar la aireación es la colocación de unos tubos timpanostómicos. Estos tubos atraviesan el tímpano y sobre su superficie se adhieren bacterias formando biofilms. Biofilms sobre implantes médicos Los biofilms sobre implantes médicos pueden estar compuestos por bacterias Gram positivas, Gram negativas o levaduras. Estos microorganismos proceden de la piel del propio paciente, del personal sanitario o del ambiente. Pueden estar formados por una única especie o por múltiples especies, dependiendo del implante y de la duración de su uso en el paciente. Cuando un implante se contamina con bacterias varios factores influyen en que se desarrolle un biofilm sobre el mismo. Inicialmente los microorganismos deben adherirse a la superficie del implante el tiempo suficiente para que la adherencia sea irreversible. Esta adherencia depende del flujo de líquido al que está sometido el implante, del número de bacterias que se adhieren y de las características físico-químicas del implante. En el caso de catéteres venosos centrales, la superficie del catéter acaba recubierta de proteínas del plasma, y otras proteínas de los tejidos como fibronectina, fibrinógeno, etc. Estas proteínas favorecen la unión de las bacterias que posean adhesinas para las mismas. En el caso de sondas urinarias, la fuente de contaminación puede ascender desde la bolsa recolectora, entrar en el lumen del catéter a través del exudado en el punto de entrada del catéter. En este caso las bacterias se unen directamente al material del catéter sin que intervengan proteínas del paciente. Una vez que la bacteria se ha adherido a la superficie del implante y ha formado el biofilm, este biofilm actúa como una fuente de infección sobre todo en pacientes inmunocomprometidos. Los mecanismos por los que el biofilm produce los síntomas de la enfermedad todavía no están completamente establecidos, pero se ha sugerido que las bacterias del biofilm pueden producir endotoxinas, se pueden liberar grupos de bacterias al torrente sanguíneo, se vuelven resistentes a la acción fagocitaria de las células del sistema inmune y por otro lado, constituyen un nicho para la aparición de bacterias resistentes a los tratamientos antibióticos. Este último aspecto puede ser especialmente relevante dado que las bacterias resistentes originadas en un biofilm podrían extenderse de paciente a paciente a través de las manos del personal sanitario. Biofilm y resistencia a antibióticos La característica que mejor distingue las infecciones crónicas relacionadas con biofilms de las infecciones agudas es su respuesta a tratamientos antibióticos. Mientras que las infecciones agudas pueden ser eliminadas tras un breve tratamiento antibiótico, las infecciones por biofilms normalmente no consiguen ser completamente eliminadas, producen episodios recurrentes y la mayoría de las veces deben resolverse sustituyendo el implante. Esto se debe a que las bacterias del biofilm pueden ser hasta 1.000 veces más resistentes a los antibióticos que esas mismas bacterias crecidas en medio líquido. Estrategias de intervención frente a infecciones por biofilms sobre implantes Los microorganismos pueden colonizar la prótesis en el momento de su colocación, por inoculación directa durante la manipulación del tejido o el implante o por contaminación aérea de la herida; y después del implante, por diseminación hematógena, durante una bacteriemia o por extensión directa, a partir de un foco adyacente de infección. La contaminación del implante en el momento de la intervención quirúrgica se puede evitar mediante quimioprofilaxis quirúrgica y/o la utilización de quirófanos dotados de flujo laminar. La posible contaminación posterior se puede evitar mediante el diagnóstico y tratamiento precoz de las infecciones y mediante el uso de quimioprofilaxis en intervenciones y procedimientos médicos que pueden llevar a bacteriemia como extracciones dentarias,
sondaje, etc. El tratamiento antibiótico sistémico en general no consigue la erradicación del biofilm pero en general se debe implantar para destruir las bacterias que pasan al torrente circulatorio. El tratamiento antibiótico sistémico debe ser inicialmente de amplio espectro y debe ser sustituido por antibióticos específicos cuando el laboratorio de microbiología informe la identificación y la susceptibilidad del microorganismo causante de la infección. Dado que un número muy elevado de infecciones asociadas a implantes están causadas por bacterias Gram positivas del género estafilococo, vancomicina y teicoplanina son los antibióticos de primera elección para el tratamiento de estas infecciones. Sin embargo, muy pocas infecciones asociadas a implante resuelven satisfactoriamente, y la recurrencia es muy común. Dado que el tratamiento antibiótico sistémico resulta ineficaz, se han utilizado distintas estrategias para el control y tratamiento de las infecciones asociadas a implantes. Como ejemplo hemos escogido los dos tipos de infecciones más frecuentes la infección asociada a catéteres intravasculares y la infección de prótesis articulares. Tratamiento de infección asociada a catéteres intravasculares La retirada del catéter es el tratamiento más efectivo; sin embargo, en el caso de los catéteres intravasculares tunelizados centrales la retirada puede resultar problemática y el riesgo quirúrgico que supone la retirada puede ser mayor que el riesgo asociado a un tratamiento antibiótico ineficaz. En estos casos se recomienda un tratamiento denominado de sellado antibiótico, que consiste en instilar en el interior del catéter una solución de anticoagulante (heparina o EDTA) y antibiótico a una concentración entre 100 y 1.000 veces mayor que la concentración mínima inhibitoria del microorganismo responsable de la infección asociada a catéter, durante al menos 8 horas diarias a lo largo de 10-14 días33. Los antibióticos que mejores resultados están ofreciendo en este tipo de tratamiento son gentamicina, levofloxacina, cotrimoxazol, minociclina, teicoplanina y vancomicina. El uso de catéteres impregnados con antimicrobianos o antiinfecciosos ha sido otra estrategia aunque su eficiencia está en discusión. Los antibióticos/antiinfecciosos más utilizados para impregnar los catéteres son cefazolina, Chlorhex-sulfadiazina de plata, minociclina-rifampicina, impregnación de plata-iontoforesis. Tratamiento de infecciones sobre prótesis articulares El tratamiento de las infecciones de prótesis articulares incluye terapia antimicrobiana agresiva junto con procedimientos quirúrgicos que incluye desbridamiento completo para retirar todos los materiales infectados incluyendo el segmento y los tejidos desvitalizados y el hueso. En la mayor parte de los casos los intentos para salvar la prótesis son infructuosos y es necesaria la retirada del implante junto con una pauta antimicrobiana apropiada de larga duración y posterior reimplantación de la prótesis articular. Recientemente un consorcio de bioquímicos, microbiólogos, cirujanos e ingenieros de sistemas microelectromecánicos se han unido para desarrollar un implante inteligente que sería capaz de detectar la presencia en la superficie de patógenos bacterianos, bloquear sus sistemas de transducción de señal y tratar la infección incipiente con altas dosis de antibióticos localizados y comunicar los resultados de las acciones tomadas al personal responsable del cuidado del paciente a través de telemetría35. Este es un ejemplo ilustrativo de cómo diferentes disciplinas pueden ofrecer soluciones imaginativas a las infecciones asociadas a implantes en un futuro no muy lejano.
Conclusión.
Las bacterias han crecido en biofilms durante millones de años, como parte de una estrategia exitosa para colonizar el planeta y la mayoría de los seres vivos. La formación de biofilms representa un problema para aquellos pacientes que requieran un implante o utilización de prótesis removibles o no. Los microorganismos del biofilm son muy difíciles de tratar con agentes antimicrobianos ya que se trata de formas de resistencia, y la liberación de bacterias desde el biofilm puede provocar una infección, sobre todo si el paciente esta inmuno comprometido. Es necesario llevar a cabo un estudio profundo de estas estructuras en general y en particular de cada uno de los microorganismos que sean capaces de desarrollarlo, nuevos métodos para detectar la presencia de biofilm como así también diseñar estrategias de control que en combinación con nuevos fármacos antimicrobianos permitan instaurar tratamientos precoces y efectivos para su erradicación y/o tratamiento de la infección producida por biofilm Todos los esfuerzos dirigidos a la identificación de genes que sean necesarios para la formación del biofilm, la búsqueda de enzimas capaces de degradar específicamente la matriz polisacarídica del biofilm, métodos físicos como ultrasonidos que perturben la estabilidad de la matriz o los estudios dirigidos a descifrar los patrones de expresión génica entre las bacterias planctónicas y las bacterias del biofilm deben ser considerados como fuente de posibles estrategias que nos ayudarán a comprender y combatir mejor las infecciones producidas por biofilms bacteriano
Bibliografía.
Richards, J. J. & Melander, C. (2009) Controlling bacterial biofilms. Chembiochem.10: 2287-2294
Cotter, P. A. & Stibitz, S. (2007) c-di-GMP-mediated regulation of virulence and biofilm formation. Curr. Opin. Microbiol. 10: 17-23.
Branda, S. S., Vik, A., Friedman, L. & Kolter, R. (2005) Biofilms: the matrix revisited. Trends Microbiol. 13: 20-26.
Hall-Stoodley, L., Costerton, J. W. & Stoodley, P. (2004) Bacterial biofilms: from the natural world to infectious disease. Nat. Rev. Microbiol. 2: 95-108.
O’Toole, G., Kaplan, H. B. & Kolter, R. (2000) Biofilm formation as microbial development. Annu. Rev. Microbiol. 54: 49-79.